RayBiotech抗体芯片在CAFs与肿瘤耐药性研究中的应用
杂志名称:Cell
文献题目:CD10+GPR77+ Cancer-Associated FibroblastsPromote Cancer Formation and Chemoresistance by Sustaining Cancer Stemness
第一作者:ErweiSong
作者单位:Guangdong Provincial Key Laboratory of Malignant Tumor Epigenetics and Gene Regulation, Medical Research Center, Sun Yat-Sen Memorial Hospital, Sun Yat-Sen University, Guangzhou 510120, China
本实验所用产品:RayBiotech人AAH-CYT-5抗体芯片(80个细胞因子抗体芯片)
实验样品:胸腺癌患者肿瘤组织
研究背景:
肿瘤干细胞(CSCs)是对肿瘤形成和肿瘤耐药性起到重要作用的细胞群,但未有对其的标记物。肿瘤相关成纤维细胞(CAFs)是许多恶性肿瘤(如胸腺癌/肺癌等)共有的癌细胞,许多研究表明CAFs在肿瘤形成和恶化过程中对肿瘤干细胞(CSCs)有影响,但由于CAFs有许多不同的亚群,各自分泌不同的细胞因子,无法判断出是哪一类CAF作用于CSCs。本文旨在探究是哪一类CAFs亚群分泌了哪些蛋白分子影响CSCs,使其对化疗药物产生抗性,促使癌症发展。
![]()
1 结果
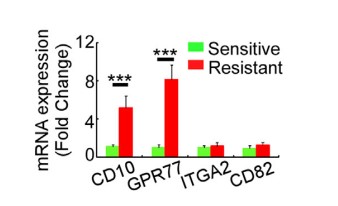
1.1 验证在胸腺癌和肺癌患者中发现的一种高表达CD10和GPR77的CAF细胞亚群与肿瘤耐药性和低存活的相关性
为了探究是哪一种CAFs亚群影响肿瘤耐药性和低存活,收集了578位化疗前后的胸腺癌患者的组织样品,分离出CAF同癌细胞共培养,发现耐药性癌组织中CAF对癌细胞有影响。采用mRNA芯片检测mRNA表达量,发现CD10和GPR77基因表达量上调,流式免疫荧光染色,表明CD10和GPR77蛋白在耐药性肿瘤组织CAF中的表达。
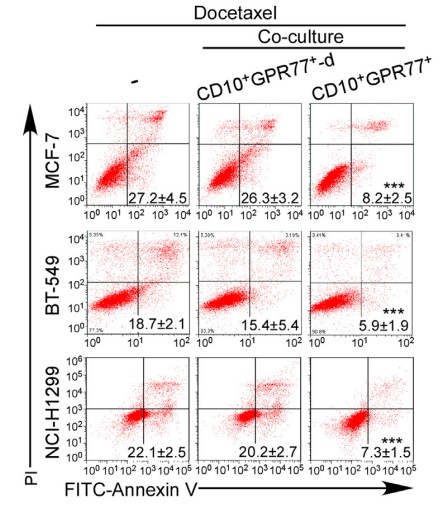
1.2 验证CD10+GPR77+CAF诱导癌细胞耐受和自身耐受
为探究高表达CD10和GPR77的CAF亚群是否通过诱导细胞耐受影响癌细胞,收集CD10+GPR77+ CAF,同抑制药物处理的癌细胞共培养,发现CD10+GPR77+ CAF有效维持了癌细胞系和原代癌细胞的存活。
为更明显的说明诱导效果,注射癌细胞到免疫功能不全的小鼠乳腺中,建立移植瘤小鼠模型。发现CD10+GPR77+ CAF不止自身抵抗化疗,还能诱导肿瘤细胞在其CAF微环境影响下耐受。
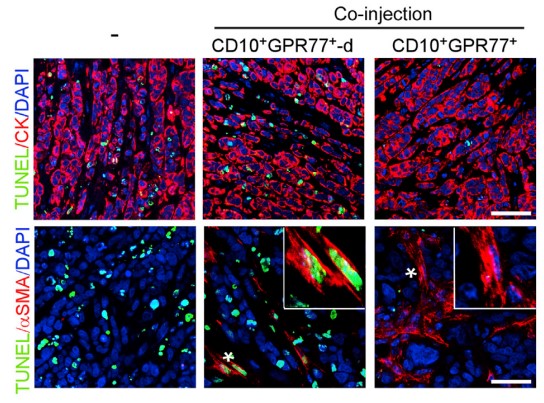
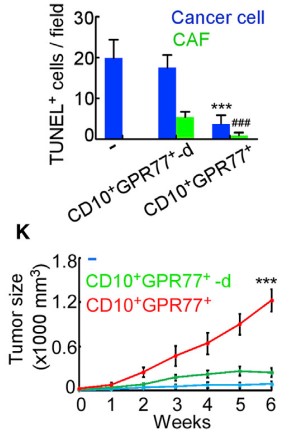
1.3 验证CD10+GPR77+CAF组成CSCs 的Supporting Niche(微环境)
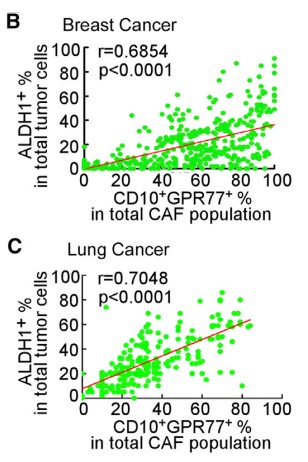
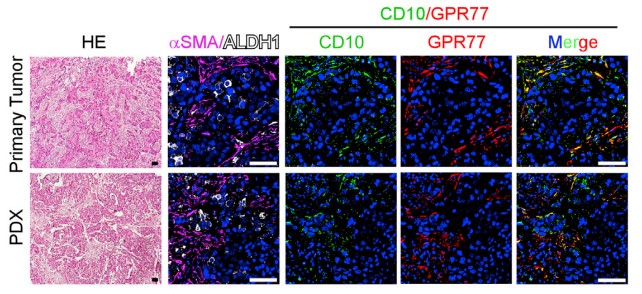
由于在胸腺癌耐药性样本中发现ALDH1+ CSCs的比例升高,进行临床胸腺癌CSCs和CD10+GPR77 CAF的相关性实验,在ALDH1+CSCs中发现CD10+GPR77+ CAF,建立派生瘤模型(PDX),进一步探究在移植瘤模型中CD10+GPR77+CAF是否有助于肿瘤形成的能力,发现了胸腺癌基质中的CD10+GPR77+CAFs有助于PDX的建模和通过CSC增殖形成肿瘤的能力。
1.4 验证CD10+GPR77+CAFs通过分泌白介6(IL6)和白介素8(IL8)诱导CSCs增殖
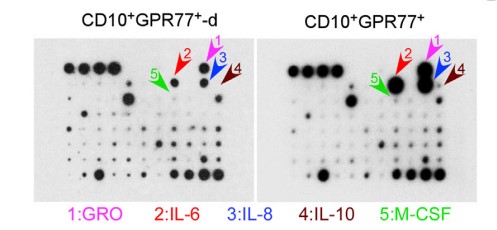
为探究CD10+GPR77+ CAFs的作用机制,使用人类蛋白抗体芯片检测了CD10+GPR77+CAFs分泌的蛋白因子,通过蛋白板检测CD10+GPR77+CAFs分泌蛋白,发现了IL-6 和 IL-8蛋白量在CD10+GPR77+CAF明显增多,说明CD10+GPR77+ CAF通过分泌IL-6 和 IL-8,促进CSC增殖和肿瘤派生转移,诱导肿瘤耐受性,分别进行沉默IL-8基因和IL6基因,发现CD10+GPR77+CAFs产生IL-8,IL-8依赖于IL6调控。

1.5 验证通过P300调控P65乙酰化延迟NF-kB激活,以维持CD10+GPR77+CAFs的表型和功能
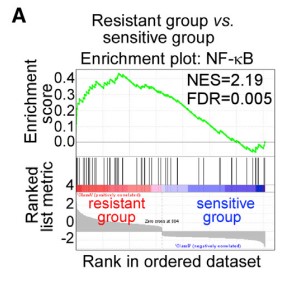
为解释CD10+GPR77+CAFs持续产生IL6和IL8激活信号通路的机制,进行了富集分析GSEA(gene set enrichment analysis)、WB(Western Blotting)发现在CAFs中,通过p65磷酸化(S536)和乙酰化(K310)维持 NF-kB的活化,同时也需要其他分子信号(如IKK活化)参与。免疫沉淀反应发现p65与p300的相互作用影响其在K310的乙酰化。

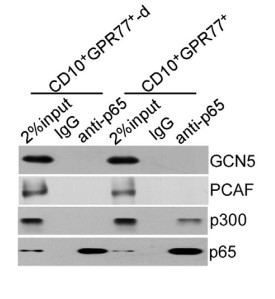
1.6 验证在CD10+GPR77+CAFs中,GPR77诱导P65磷酸化是p65乙酰化和参与NF-kB活化的前提
进一步探究CD10和GPR77 蛋白是否在CD10+GPR77+CAFs中参与信号通路和维持细胞功能。敲除GPR77基因,发现IL6和IL8分泌明显减少,NF-kB活化受到抑制,p65蛋白减少。沉默GPR77完全抑制RSK1的表达,对IKK没有明显影响。说明GPR77诱导P65磷酸化是p65乙酰化和参与NF-kB活化的前提。在MCF-7共培养胸腺癌细胞中,沉默GPR77可终止CD10+GPR77+ CAFs促进CSC增殖和耐药性的能力。由于GPR77是C5a补体的受体,进一步探究CAF自身是否产生维持GPR77信号表达的补体。发现在CD10+GPR77+CAFs产生较多C5a补体。(6J/6K)且NF-kB调控C5a产生。
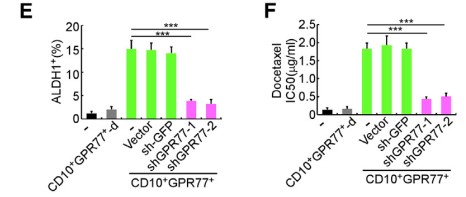

1.7 抗GPR77肿瘤抑制剂和提高化疗效果治疗胸腺癌派生瘤模型



 RayBio资讯
RayBio资讯