RayBio抗体芯片在杜氏肌营养不良症中研究的应用
杂志名称:Cellular and Molecular Life Sciences
文献题目:Lecompte, Sophie, et al. "Skeletal muscle secretome in Duchenne muscular dystrophy: a pivotal anti-inflammatory role of adiponectin." Cellular and Molecular Life Sciences 74.13 (2017): 2487-2501.
第一作者:S. Lecompte
作者单位:
Endocrinology, Diabetes and Nutrition Unit, Institute of Experimental and Clinical Research, Catholic University of Louvain
本实验所用产品:RayBio人 AAH-CYT-1000抗体芯片(120个细胞因子抗体芯片)
实验样品:细胞培养上清
研究背景:
杜氏肌营养不良是一种X染色体隐性遗传疾病,主要发生于男孩。据统计,全球平均每3500个新生男婴中就有一人罹患此病。患者在学龄前就会因骨骼肌不断退化出现肌肉无力或萎缩,导致不便行走。大概在7岁到12岁时,会彻底丧失行走能力,通常到20多岁就会因为心肌、肺肌无力而死亡。针对该病,医学界尚无有效疗法。杜氏肌营养不良,一种危害人们的健康的疾病。肌营养不良蛋白缺陷型肌纤维的收缩会产生严重的损伤,并产生肌纤维坏死和再生的循环。这些改变导致慢性炎症,这是这种疾病的发病机制的关键特征。在这种情况下,细胞因子和趋化因子在DMD相关的肌肉炎症中发挥重要和多样化的作用。前期研究表明脂联素(ApN)在骨骼肌上表现出抗炎性质,并减轻mdx小鼠的营养不良表型。在这里,我们研究ApN是否在DMD患者获得的肌管细胞中保留其抗炎作用。我们通过研究其分泌物和ApN的早期关系来揭开潜在的机制。

1 分组
细胞培养上清样本:
DMD组成肌细胞上清(n=4)
对照组成肌细胞上清(n=3)
2 结果
2.1 DMD组及对照组肌小管细胞鉴定
成肌细胞分化为肌管在对照(C)和DMD细胞之间没有差异,如分化开始后第0,3和11天(即分化前后,中期和晚期阶段)。更具体地说,在第11天,成熟肌管在两组中表现出相同的特征性。同样,在分化过程中,在C和DMD细胞中,肌原性标记的基因表达也相似地增加。

2.2 DMD组及对照组自身的脂联素表达
我们检测了基础状态下ApN的生产。与对照组相比,营养不良肌管的ApN mRNA和蛋白表达分别下降约60%〜15%。 这暗示了DMD肌管中ApN的潜在缺陷,并支持推荐肌营养不良中ApN补充的理论。
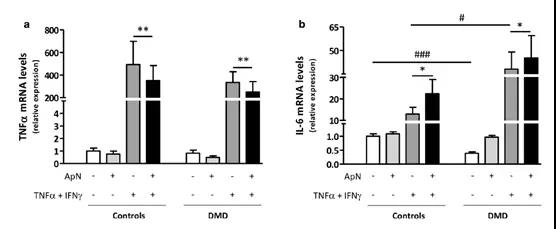
2.3 脂联素在人类对照和DMD肌管中的抗炎特性
随后对ApN治疗是否在营养不良肌肉中保持其抗炎特性进行研究。为了模拟DMD的炎症微环境,通过炎症因子(TNFα/IFNγ)对肌管进行了刺激,TNFα在恶化疾病中起着关键的致病作用。在C肌管中,TNFα与INFγ结合诱导其自身的基因表达,IL-6的表达被认为是抵抗炎症状态的表现。伴随的ApN治疗,TNFα基因表达的下调(〜-30%),进一步上调IL-6(〜+ 75%)的表达。ApN实际上下调了TNFα mRNA(〜-25%),同时进一步上调IL-6mRNA(〜+ 20%)。 这些数据表明ApN可能在营养不良的肌肉中保留其抗炎特性。

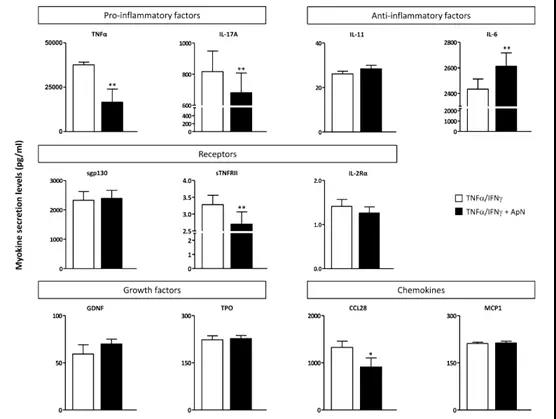
2.4 抗体芯片筛选ApN作用下细胞上清中的差异因子
筛选来自DMD肌管的培养基在或不存在ApN处理的情况下炎症刺激所引起的变化。在测试的120个细胞因子中,64个由肌管分泌。在ApN存在的情况下,10种蛋白分泌有差异:8种细胞因子低分泌,而另外两种则分泌过量。这些肌肉蛋白属于五个家族:促炎因子和抗炎因子/细胞因子,生长因子,可溶性受体和趋化因子。接下来用ELISA定量这些差异因子进行验证。结果表明,通过ApN处理下调两种促炎因子(TNFα和IL-17A),一种可溶性受体(sTNFRII)和一种趋化因子(CCL28)的分泌。相反,只有IL-6上调,其可能具有抗炎特性。
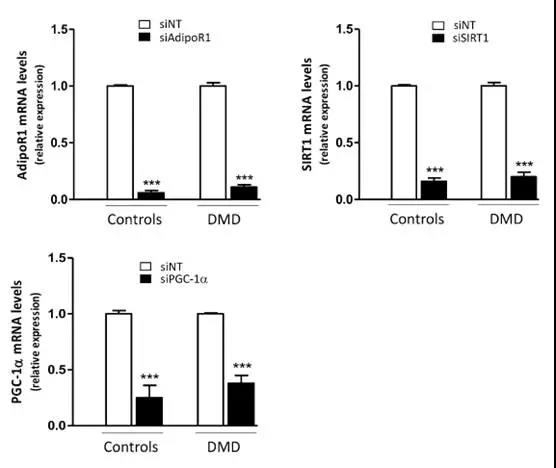
2.5 ApN在对照组和DMD肌管中的抗炎作用的机制
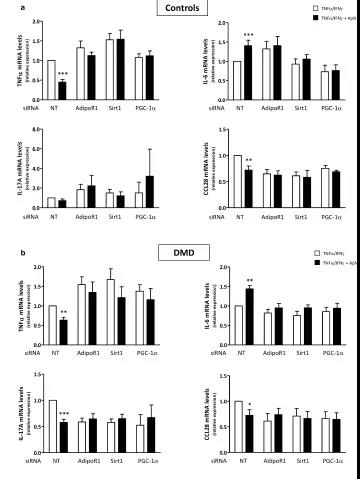
接下来研究连接AdipoR1-SIRT1-PGC-1α的信号通路是否参与了DMD肌管中ApN的抗炎作用。为此,使用特异性siRNA敲除了该途径的每个组分。首先证实,siRNA沉默是有效的,如靶基因表达的显着降低(-65至-95%)。接下来,证明在C肌管中,ApN在存在的条件下发挥其抗炎作用:它降低TNFα(〜55%)和CCL28(-28%) 同时增加IL-6 mRNA(+ 40%)。
当用针对AdipoR1,SIRT1或PGC-1α的siRNA转染肌管时,这些变化被消除。因此,AdipoR1-SIRT1-PGC-1α信号通路的每个组分似乎是ApN在C和营养不良肌肉中的抗炎作用所必需的。
结论:
首先,与对照组相比,营养不良肌管的基础ApN表达和分泌降低。之前的研究已经表明,在急性或慢性炎症的环境中,ApN在体内被“正常”的小鼠骨骼肌过度产生,以局部抵消过度和有害的炎症反应。相比之下,mdx小鼠的骨骼肌不能局部过度产生ApN。同样,这种情况似乎在人类营养不良肌管中也有同样的表现,与对照相比,ApN表达降低。这表明在DMD肌管中ApN的潜在缺陷,并支持在该病理学中推荐ApN补充的说法。 ApN对肌细胞分泌状况的影响仍然很大程度上是不明确的。为了研究ApN治疗前后DMD肌管的分泌物谱。使用Rybiotech的细胞因子抗体芯片进行检测并用ELISA方法进行验证,我们确定了几种由人类营养不良肌管分泌的肌动蛋白是由ApN调节。这些肌肉蛋白属于四个家族:抗炎因子/细胞因子,可溶性受体和趋化因子。ApN下调了几种促炎症分子(TNFα,IL-17A和CCL28),同时上调IL6,其在免疫应答中起双重作用。据我们所知,这两种分子(sTNFRII,CCL28)是人肌管的新型分泌产物。ApN通过AdipoR1和AMPK-SIRT1-PGC-1α途径介导其对控制肌管的保护,从而导致转录因子NF-κB表达下调。总之,ApN通过激活AdipoR1和AMPKSIRT1-PGC-1α途径在营养不良的肌肉中保持其有益的性质,从而诱导下游肌肉分泌向较少炎症分布的转变,同时上调utrophin A、及其下游肌肉ApN,这机制可能成为治疗DMD的关键点,Raybiotech的抗体芯片在该机制的研究中起重要作用。




 RayBio资讯
RayBio资讯